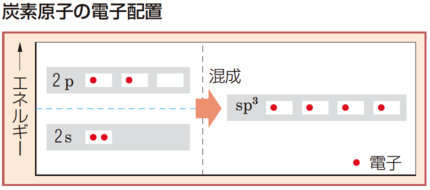
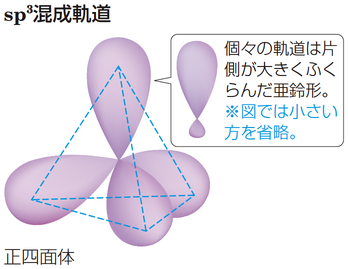
複数の電子軌道が混ぜ合わさってできる電子軌道。
K殻には1s軌道,L殻には2s軌道と2p軌道があり,収容できる電子の数は,1s軌道が2個,2s軌道が2個,2p軌道が6個になる。なお,2p軌道は,$2\text{p}_x$軌道,$2\text{p}_y$軌道,$2\text{p}_z$軌道の3つからなり,各軌道に2個ずつ電子が収容できる。炭素原子の電子6個が,エネルギーの低い順に,1s軌道に2個,2s軌道に2個,2p軌道に2個が収容されると,2p軌道に2つの不対電子ができ,炭素の原子価は2になるが,実際の炭素の原子価は4である。
炭素の原子価が4になるのは,2s軌道と2p軌道が$\text{sp}^3$混成軌道をつくり,同じエネルギーで向きが異なる4つの軌道になることで説明できる。