電子配置(入試実例)
電子配置について,入試実例(2023年名古屋大学)を解きながら解説する。
グレーバックの部分が入試からの引用で,今回のテーマと関係のない部分を一部割愛している。なお,解答・解説は浜島書店が作成したものである。
次の文章を読んで,設問に答えよ。
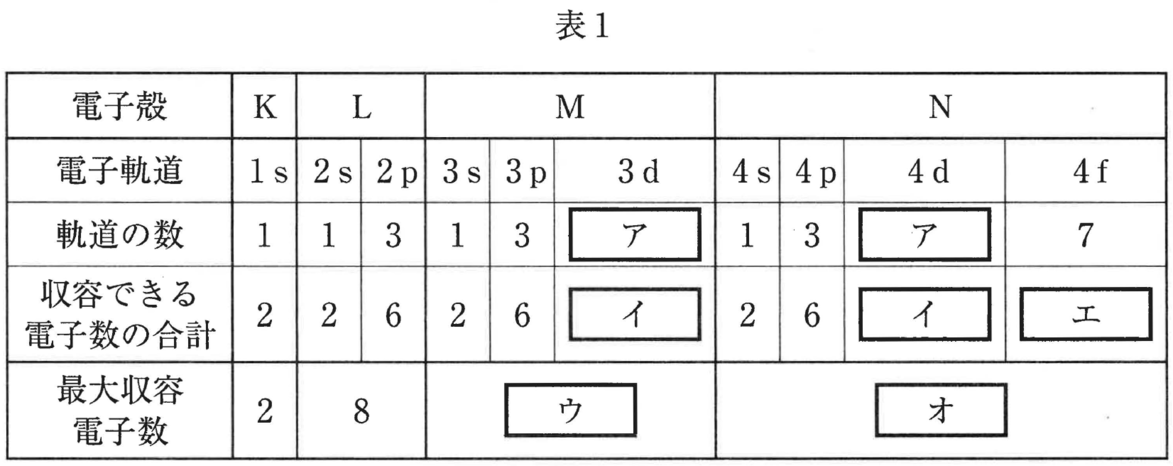
原子の中の電子は,K殻,L殻,M殻,N殻…という電子殻に収容される。電子殻中にはさらに,電子が収容される軌道というものが存在し,各軌道には最大2個まで電子が収容される。これらの軌道はs軌道,p軌道,d軌道,f軌道と分類される。さらに,軌道の名称には軌道を表すアルファベットの前に,K殻では1,L殻では2…と数字をつける。電子殻に存在する軌道の数と収容できる電子数は表1のようになる。
第4周期の遷移元素は最外殻電子の数が1または2という共通の特徴をもつ。原子の電子配置では,「1s→2s→2p→3s→3p→4s→3d…」のようにエネルギーの低い軌道から順に電子が入っていくことが多い。アルゴン原子 \mathsf{Ar} では3p軌道まで電子が入っているが,次の周期のカリウム原子 \mathsf{K} とカルシウム原子 \mathsf{Ca} では4s軌道に電子が入る。さらに,スカンジウム原子 \underline{\mathsf{Sc}} 以降の遷移元素になると4s軌道と3d軌道へ部分的に電子が入るようになる。その結果,最外殻の電子数が1または2となる。
(中略)
設問⑴ 表1の空欄 \fbox{\text{ ア }} 〜 \fbox{\text{ オ }} にあてはまる整数を記せ。
s軌道には1個,p軌道には3個,d軌道には5個の軌道がある。各軌道には2個の電子が収容できる。
また,最大収容電子数は,K殻が2個,L殻が8個,M殻が18個,N殻が32個で,n 番目の電子殻では 2n^2 個になる。
解答
ア 5 イ 10 ウ 18 エ 14 オ 32
設問⑵ (省略)
設問⑶ 下線部に関して,第4周期のクロム原子 \mathsf{Cr} と銅原子 \mathsf{Cu} だけは4s軌道に電子が1個,他は4s軌道に電子が2個入る。したがって,第4周期の3〜11族の元素の中で3d軌道の電子数が同数となる原子が1組存在する。それらの原子番号と3d軌道の電子数を答えよ。
3d軌道には軌道が5つあり,各軌道には2個ずつ電子を収容できる。電子は,各軌道に1個ずつ入っていき,すべての軌道に電子が1個ずつ入った後,2個目の電子が収容されていく。
3d軌道の各軌道に1個ずつ,合計5個の電子が入ったとき,エネルギーが低い状態になる。そのため,次のように,クロム \mathsf{_{24}Cr} では,4s軌道に2個目の電子が入る前に,3d軌道に5個目の電子が入る。
- バナジウム \mathsf{_{23}V} 1s(2),2s(2),2p(6),3s(2),3p(6),4s(2),3d(3)
- クロム \mathsf{_{24}Cr} 1s(2),2s(2),2p(6),3s(2),3p(6),4s(1),3d(5)
- マンガン \mathsf{_{25}Mn} 1s(2),2s(2),2p(6),3s(2),3p(6),4s(2),3d(5)
なお,収容される電子数を( )で示した。
また,銅 \mathsf{_{29}Cu} では,4s軌道に2個目の電子が入る前に,3d軌道に10個目の電子が入る。
- ニッケル \mathsf{_{28}Ni} 1s(2),2s(2),2p(6),3s(2),3p(6),4s(2),3d(8)
- 銅 \mathsf{_{29}Cu} 1s(2),2s(2),2p(6),3s(2),3p(6),4s(1),3d(10)
- 亜鉛 \mathsf{_{30}Zn} 1s(2),2s(2),2p(6),3s(2),3p(6),4s(2),3d(10)
亜鉛は12族の元素なので,題意には合わない。満たす元素はクロム \mathsf{_{24}Cr} とマンガン \mathsf{_{25}Mn} である。
解答
原子番号 24と25 3d軌道の電子数 5
(以下省略)