キレート滴定
目次
キレート
多座配位子
配位子(補足③ 配位子)は,金属に配位結合(補足① 配位結合)する原子の数によって,単座配位子(金属に配位結合する原子が1個),多座配位子(金属に配位結合する原子が複数個)に分類される。
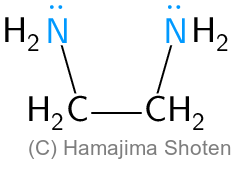
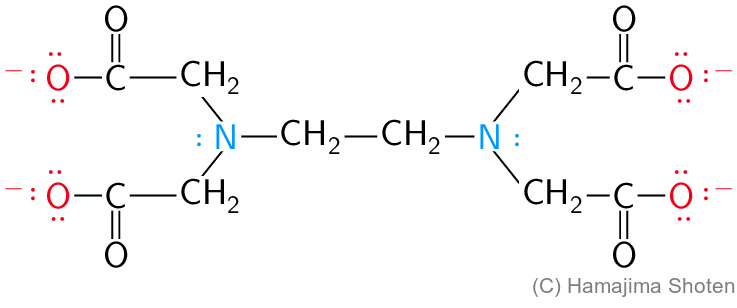
多座配位子には,たとえば二座配位子であるエチレンジアミン( \mathsf{en} と略記),六座配位子であるエチレンジアミン四酢酸イオン( \mathsf{EDTA^{4-}} と略記)などがある(図1,2)。
キレート
二座配位子であるエチレンジアミンが,コバルトイオン(Ⅲ) \mathsf{Co^{3+}} (配位数6,補足④ 配位数)に配位結合してできた錯イオン \mathsf{[Co(en)_3]^{3+}} (補足② 錯イオン)の構造は,図3のようになる。
![図3:\mathsf{[Co(en)_3]^{3+}}の構造(\mathsf{H}を省略した)](./images/2024072901f13.png)
エチレンジアミン( \mathsf{en} )は,配位結合をする原子が2個含まれているので,\mathsf{en} 3個が配位数6の \mathsf{Co^{3+}} と配位結合して,正八面体の構造の錯イオンになる。このとき,\mathsf{Co^{3+}},配位子の2つの窒素原子 \mathsf{N},2つの炭素原子 \mathsf{C} で,五角形の環(五員環)が3個できる。
このように,金属とそれに結合する配位子とでできる環構造をキレート環といい,キレート環を含む錯体(補足⑤ 錯体)をキレートとよぶ。
エチレンジアミン四酢酸イオン( \mathsf{EDTA^{4-}} )は,配位結合する原子が6個含まれているので,\mathsf{EDTA^{4-}} 1個が \mathsf{Co^{3+}} をとり囲むように配位結合する。このとき,図4のように,\mathsf{Co^{3+}},配位子の2つの \mathsf{N},2つの \mathsf{C} からなるキレート環が1個,\mathsf{Co^{3+}},配位子の \mathsf{N},配位子の \mathsf{O},2つの \mathsf{C} からなるキレート環が4個,合計キレート環が5個できる。
![図4:\mathsf{[Co(EDTA)]^-}の構造(\mathsf{H}を省略した)](./images/2024072901f14.png)
キレート(キレート環をもつ錯体)は,同じ金属に単座配位子が配位結合してできた錯体(キレート環をもたない錯体)よりも安定している。
キレート滴定
金属イオンが含まれている水溶液に多座配位子を加えると,金属イオンはより安定であるキレートに変化する。この反応を利用して,加えた多座配位子の量から,含まれていた金属イオンの量を求めることができる。このような滴定をキレート滴定という。
水溶液に含まれるカルシウムイオンの濃度
キレート滴定により,試料水溶液中のカルシウムイオン \mathsf{Ca^{2+}} 濃度を求める。
- 試料の水溶液 \mathsf{Ca^{2+}} 濃度が不明な水溶液(ミネラルウォーターなど)
- 滴下する水溶液 濃度がわかっているエチレンジアミン四酢酸水溶液( \mathsf{EDTA^{4-}} )
- 指示薬 エリオクロムブラックT( \mathsf{EBT^{2-}} )
このキレート滴定におけるポイントは,次の2点である。
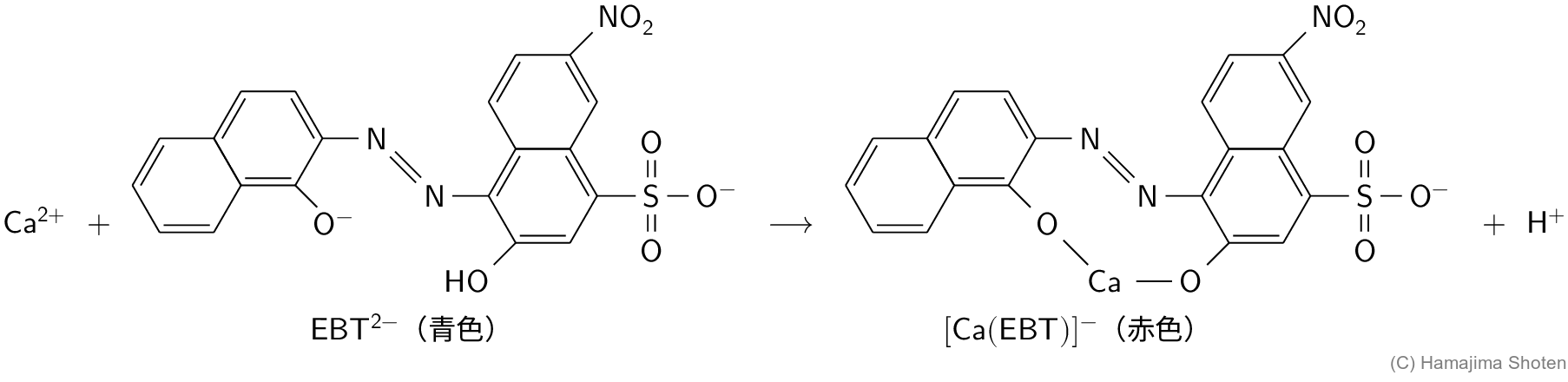
- \mathsf{EBT^{2-}} (青色)は \mathsf{Ca^{2+}} とキレート \mathsf{[Ca(EBT)]^-} (赤色)をつくる。 \mathsf{Ca^{2+}\;+\;EBT^{2-}\text{(青色)}\longrightarrow \;[Ca(EBT)]^-\text{(赤色)}\;+\;H^+}
- キレート \mathsf{[Ca(EBT)]^-} よりも,キレート \mathsf{[Ca(EDTA)]^{2-}} の方が安定である。
指示薬であるエリオクロムブラックT( \mathsf{EBT^{2-}} )は青色の溶液であるが,これを試料に加えると,図5のように,\mathsf{Ca^{2+}} とキレート \mathsf{[Ca(EBT)]}^- をつくり,試料は赤色になる。
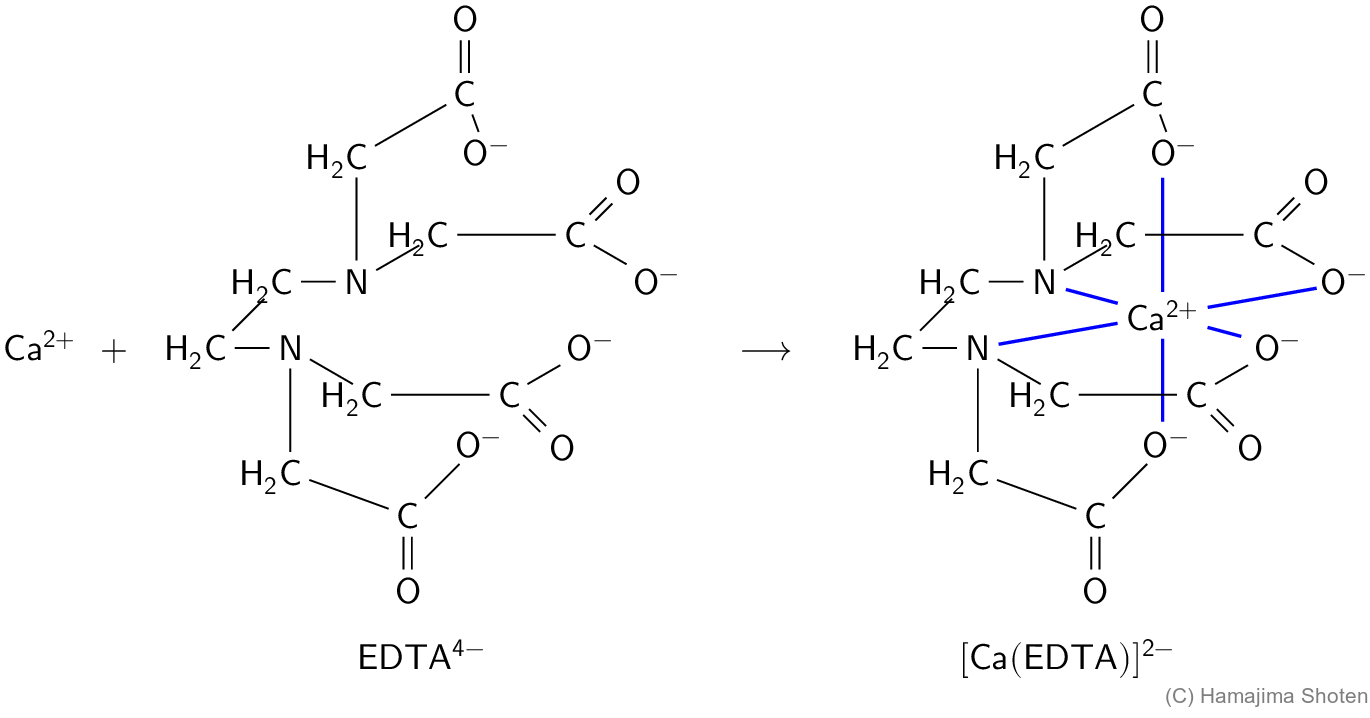
\mathsf{[Ca(EBT)]^-} (赤色)に \mathsf{EDTA^{4-}} を加えると,より安定なキレートである \mathsf{[Ca(EDTA)]^{2-}} が生じて,\mathsf{EBT^{2-}} (青色)が遊離する。
\mathsf{[Ca(EBT)]^-\text{(赤色)}+\;EDTA^{4-}\;+\;H^+\;\longrightarrow \;[Ca(EDTA)]^{2-}\;+\;EBT^{2-}\text{(青色)}}
反応が進んですべての \mathsf{[Ca(EBT)]^-} から \mathsf{EBT^{2-}} が遊離すると,赤色から青色に変化する。このときが終点である。
\mathsf{Ca^{2+}} と \mathsf{EDTA^{4-}} は,次のように 1:1 で反応する。
したがって,加えた \mathsf{EDTA^{4-}} の滴下量から,\mathsf{Ca^{2+}} 濃度を求めることができる。
補足:錯体
補足① 配位結合
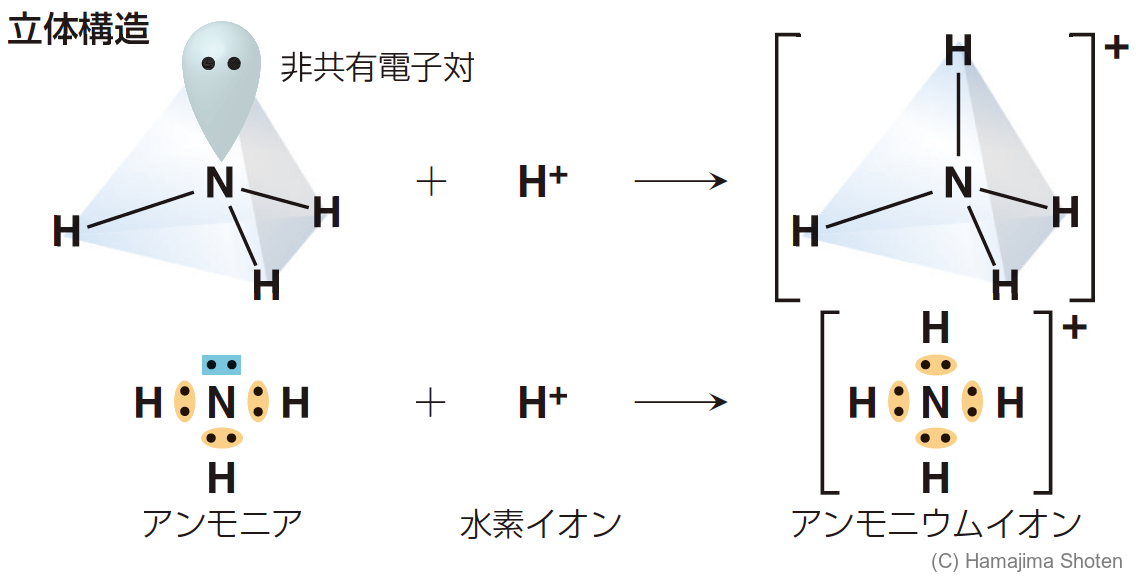
一方の原子の非共有電子対を共有する結合。
たとえば,アンモニア \mathsf{NH_3} に水素イオンが配位結合すると,アンモニウムイオン \mathsf{NH_4{}^+} ができる(図7)。
補足② 錯イオン
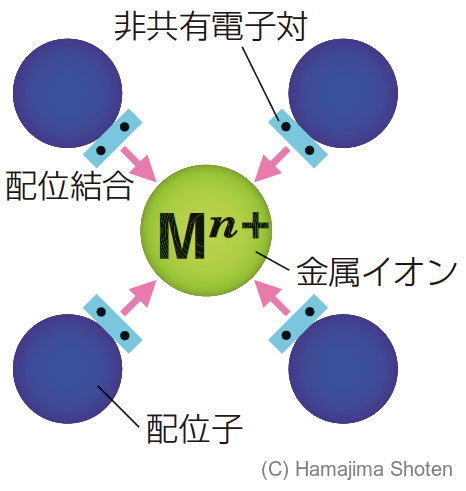
金属イオンにいくつかの分子や陰イオンが配位結合して,1つの原子集団のイオンになったもの(図8)。
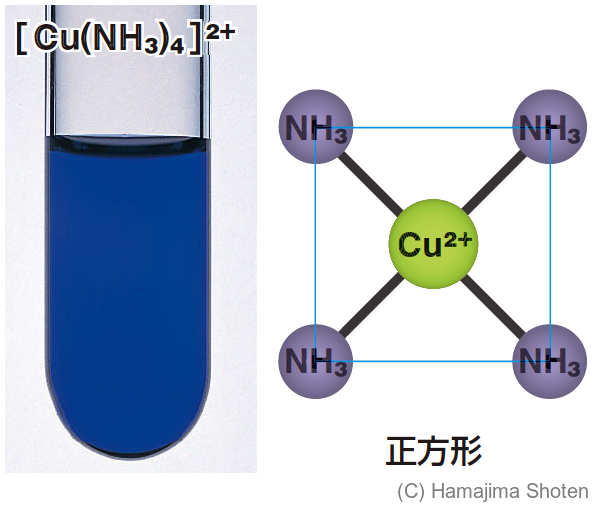
たとえば,銅イオン \mathsf{Cu^{2+}} にアンモニア分子 \mathsf{NH_3} が配位結合すると,錯イオンであるテトラアンミン銅(Ⅱ)イオン \mathsf{[Cu(NH_3)_4]^{2+}} ができる(図9)。
補足③ 配位子
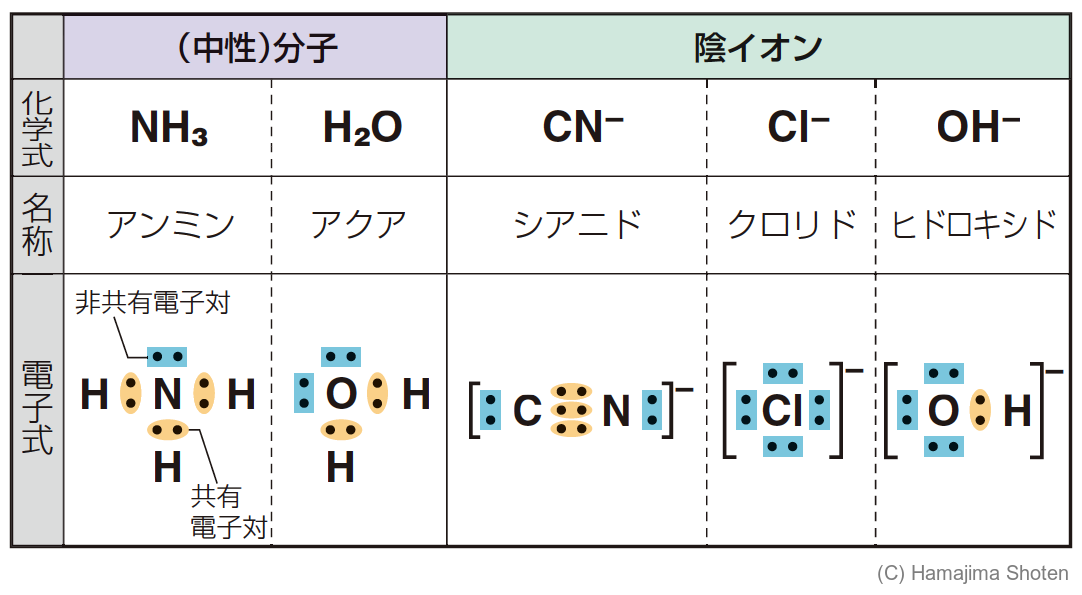
金属イオンや金属原子に配位結合する分子や陰イオン。
補足④ 配位数
金属イオンや金属原子に配位結合する分子やイオンの数。
おもな金属イオンの配位数と立体構造
| 中心イオン | 配位数 | 立体構造 |
|---|---|---|
| \mathsf{Ag^+} | 2 | 直線 |
| \mathsf{Cu^{2+}} | 4 | 正方形 |
| \mathsf{Zn^{2+}} | 4 | 正四面体 |
| \mathsf{Fe^{2+}} | 6 | 正八面体 |
| \mathsf{Fe^{3+}} | 6 | 正八面体 |
補足⑤ 錯体
配位結合を含む化合物。