糖の立体構造(入試実例)
糖の立体構造について,入試実例(2020年京都大学)を解きながら解説する。
グレーバックの部分が入試からの引用で,解答・解説は浜島書店が作成したものである。
次の文章を読んで,問1〜問3に答えよ。
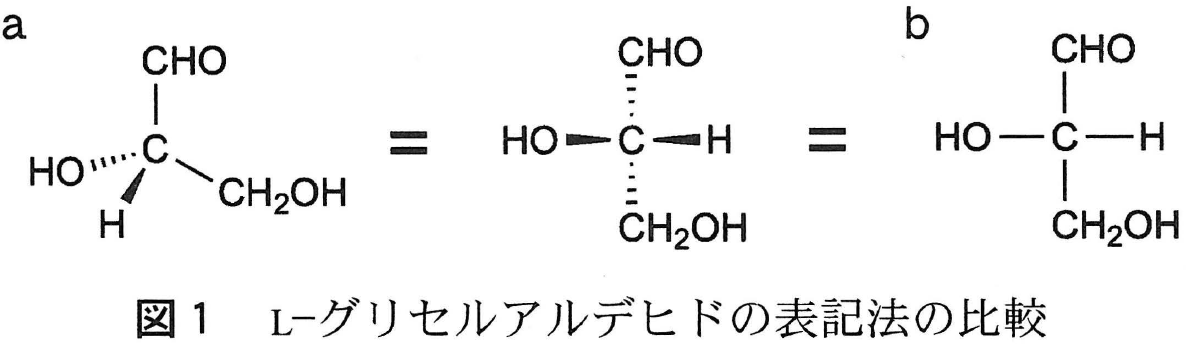
L-グリセルアルデヒドは分子内に不斉炭素原子をひとつ含む炭素数3の単糖である。その立体配置は図1aのように示すことができ,太線( )は紙面の手前側へ出ている結合,破線(
)は紙面の手前側へ出ている結合,破線( )は紙面の奥側に向かう結合を示す。これとは別に,図1bのような表記法があり,左右方向の結合は紙面の手前側に出た結合,上下方向の結合は紙面の奥側に向かう結合を示し,中心となる炭素を交点とした十字形で示される。図1bの表記法は「フィッシャー投影式」と呼ばれ,炭素原子に結合した原子あるいは原子団の立体配置を二次元的に示すための簡便な方法である。
)は紙面の奥側に向かう結合を示す。これとは別に,図1bのような表記法があり,左右方向の結合は紙面の手前側に出た結合,上下方向の結合は紙面の奥側に向かう結合を示し,中心となる炭素を交点とした十字形で示される。図1bの表記法は「フィッシャー投影式」と呼ばれ,炭素原子に結合した原子あるいは原子団の立体配置を二次元的に示すための簡便な方法である。
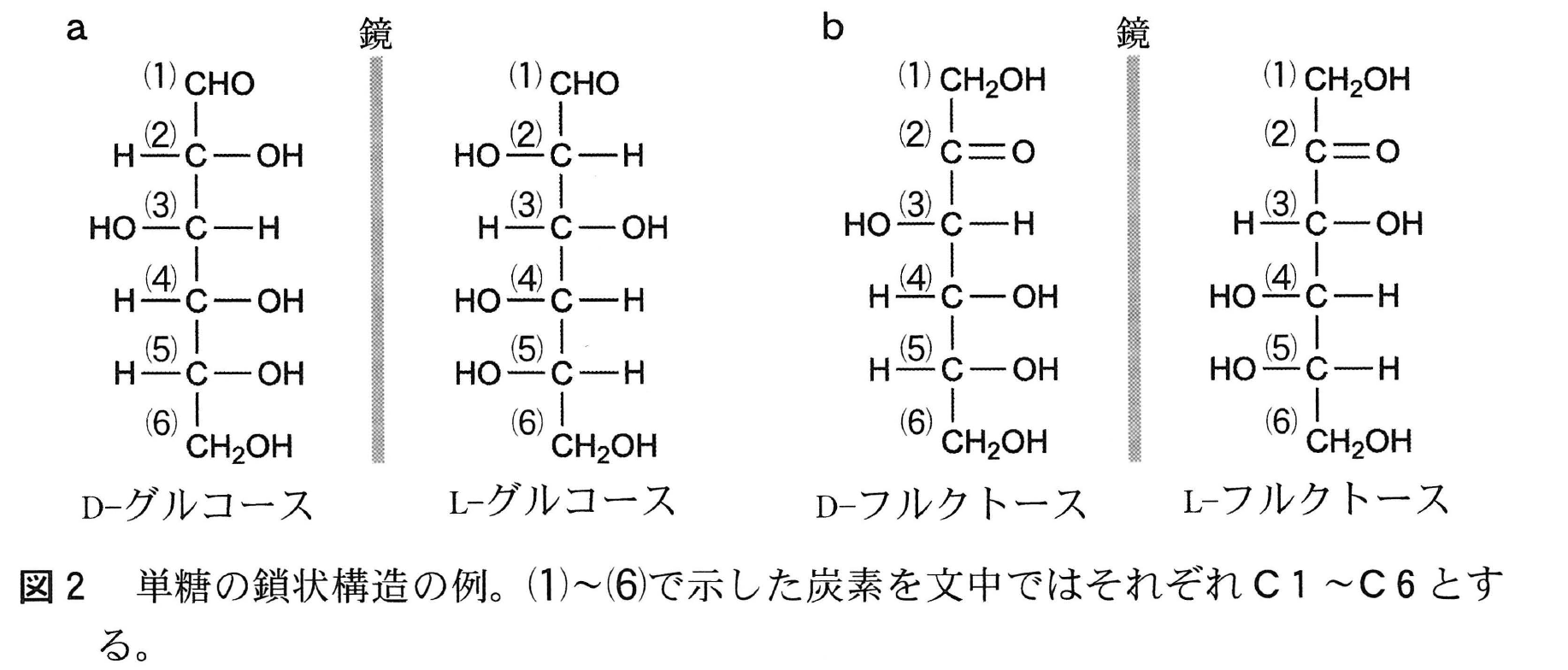
天然の単糖であるD-グルコースの鎖状構造を,フィッシャー投影式を用いて,鏡像異性体であるL-グルコースの鎖状構造とともに図2aに示した。両者を比較すると,分子内の4箇所すべての不斉炭素原子に結合した原子の配置は,鏡像の関係にある。D-フルクトース(天然型)とその鏡像異性体(L-フルクトース)についても,フィッシャー投影式を図2bに示した。
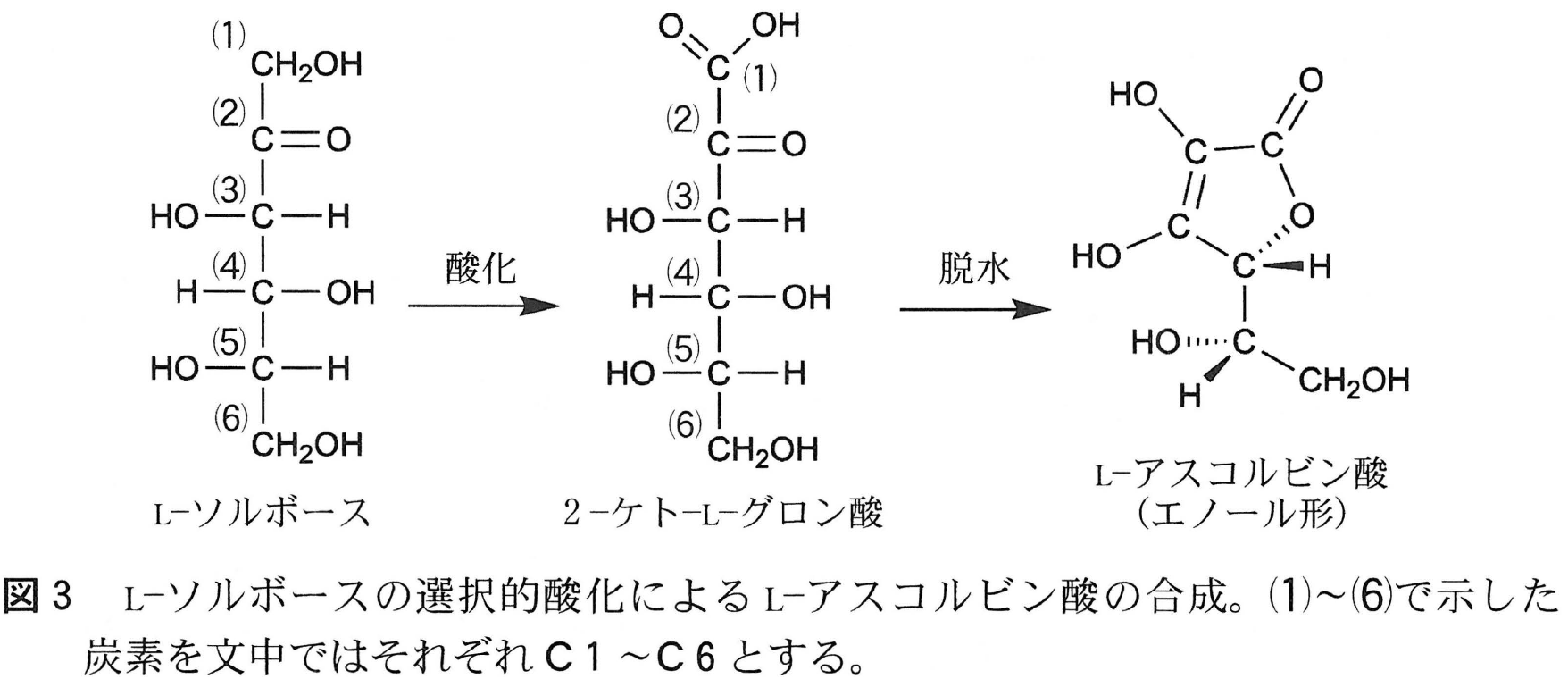
L-ソルボースはD-フルクトースの立体異性体のひとつであり,図3のフィッシャー投影式のとおり,\mathsf{C5} 炭素に結合した原子あるいは原子団の立体配置のみ,D-フルクトースと異なっている。また,D-フルクトースと同様に,水溶液中では鎖状構造と環状構造の平衡状態として存在し,\mathsf{C5} 炭素に結合したヒドロキシ基がカルボニル基と反応した①五員環構造をとることができる。
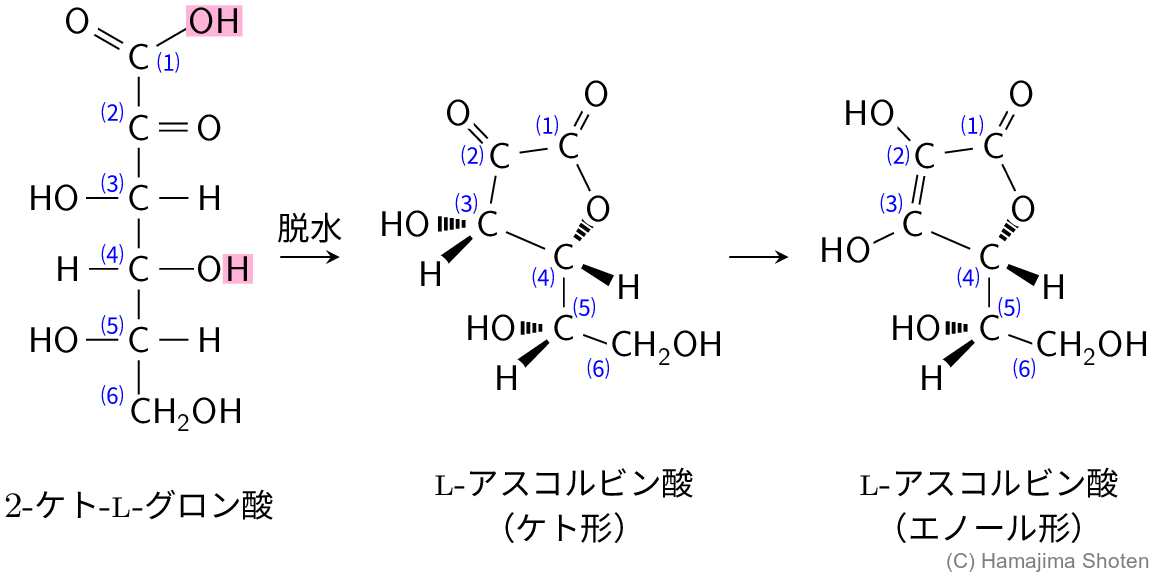
L-アスコルビン酸(ビタミンC)はL-ソルボースから図3に示した経路で合成される。まず,②L-ソルボースの \underline{\mathsf{C1}} 炭素を含む \underline{\mathsf{CH_2OH}} 基を選択的にカルボキシ基まで酸化することで,2-ケト-L-グロン酸が合成される。続いて,③脱水縮合反応によって分子内エステル結合が形成され,ケト形のL-アスコルビン酸が得られる。この化合物はエノール形のL-アスコルビン酸へ変化する。
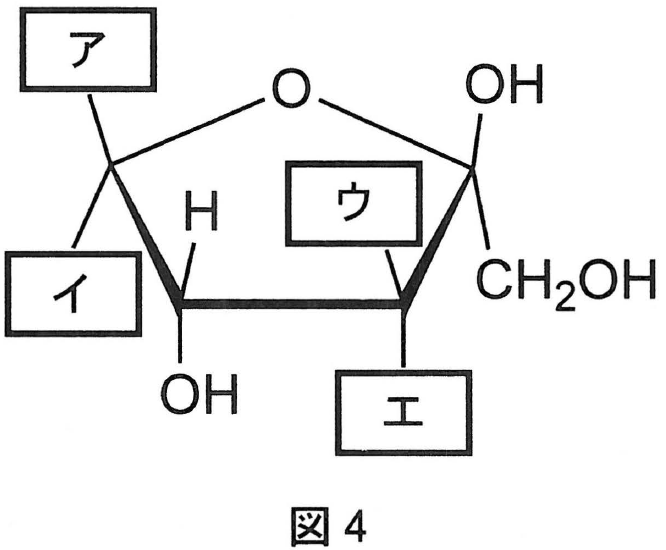
問1 下線部①のL-ソルボースの五員環構造を図4に示した。\fbox{\text{ ア }} 〜 \fbox{\text{ エ }} にあてはまる原子または原子団を化学式で答えよ。
D-フルクトースは,図Aのように,鎖状構造と環状構造(五員環)が平衡状態になっている。なお,問題の図4から,\mathsf{C2} に結合するカルボキシ基が上側であるので,β-フルクトースとした。
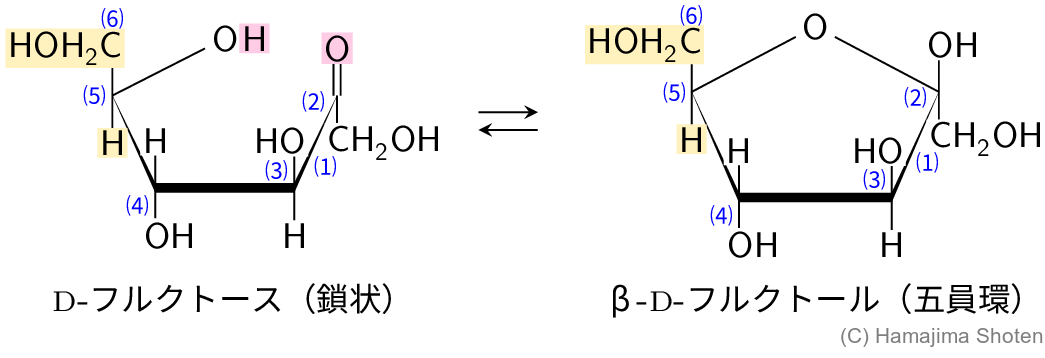
L-ソルボースはD-フルクトースの立体異性体の1つで,\mathsf{C5} 炭素に結合した原子または原子団の配置だけが異なっていることから,図Bのように,鎖状構造と環状構造(五員環)が平衡状態になっていると考えられる。\mathsf{C5} 炭素に結合する \mathsf{CH_2OH} と \mathsf{H} の配置が,D-フルクトースの逆になっていることに注意する。
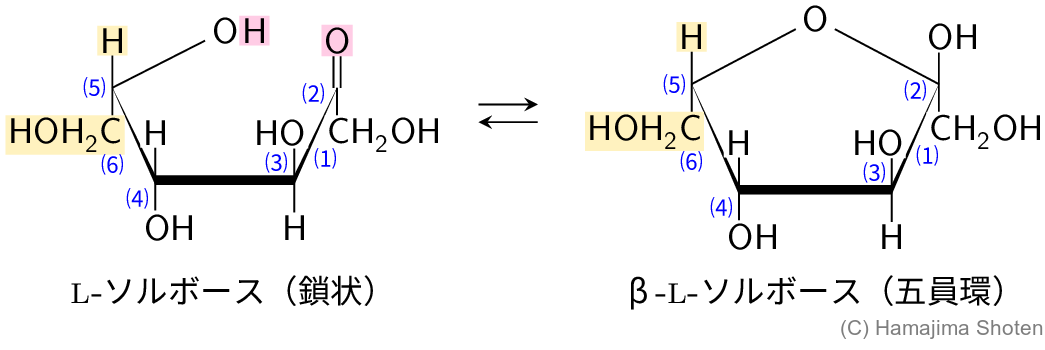
したがって,解答は次のようになる。
解答
ア \mathbf{H} イ \mathbf{CH_2OH} ウ \mathbf{OH} エ \mathbf{H}
問2 下線部②に関する次の文を読み,(ⅰ)と(ⅱ)に答えよ。
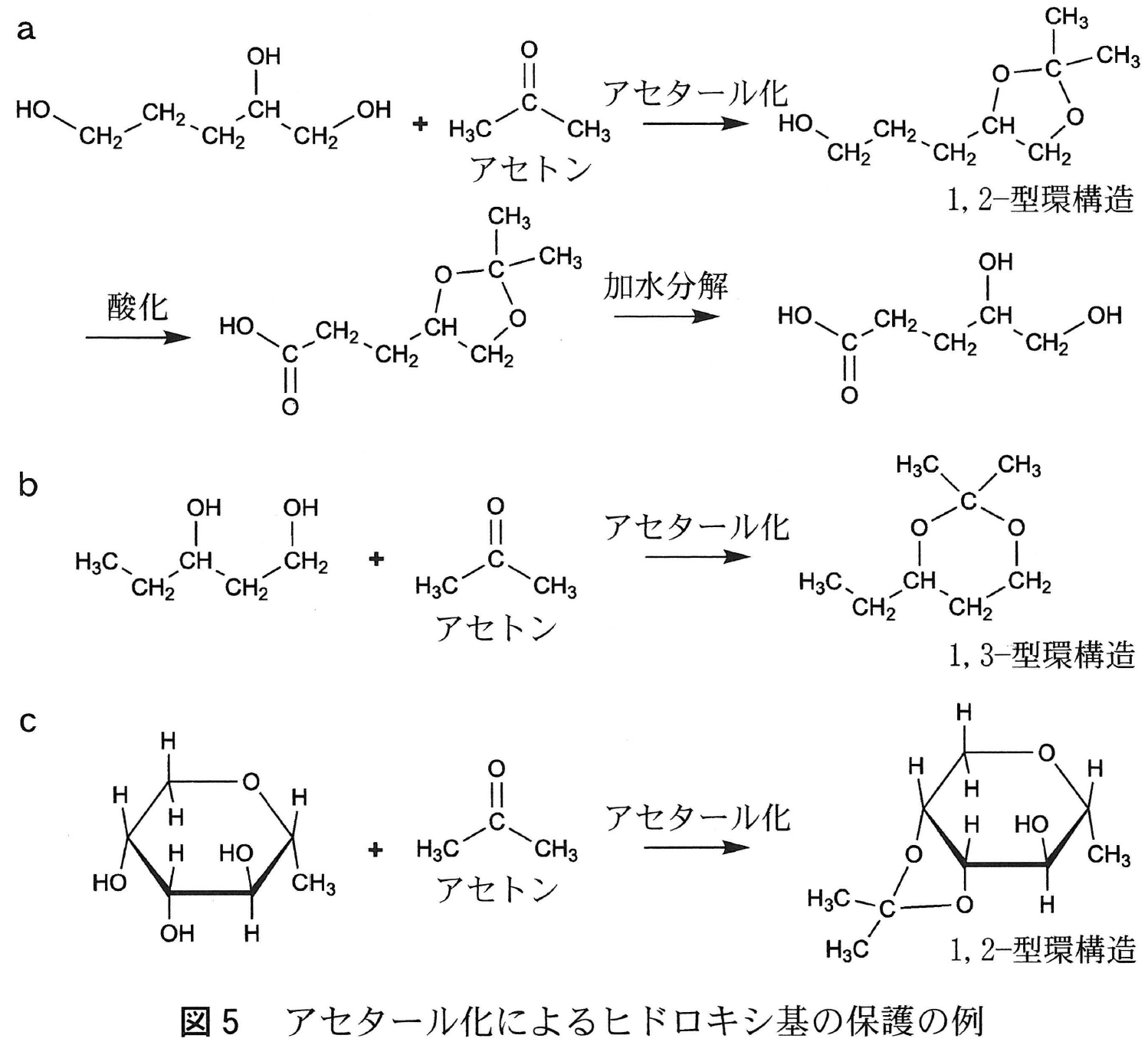
複数のヒドロキシ基をもつ化合物において,特定のヒドロキシ基のみを反応させる方法のひとつに,反応させたくないヒドロキシ基を一時的に異なる化学構造に変換し,望まない反応を防ぐという手法がある。このような手法は「保護」と呼ばれ,その概念を図5aに示した。空間的に近接した2つのヒドロキシ基を,アセトンと反応(アセタール化)させることで,五員環構造にしている。この環構造は,1,2-型環構造と呼ばれ,酸化反応の影響を受けない。一方で,酸性条件下では加水分解により開裂し,もとのヒドロキシ基に戻る。図5bのような配置のヒドロキシ基の間でもアセタール化は進行し,六員環構造(1,3-型環構造)を与える。また,分子内に3つ以上のヒドロキシ基が含まれる場合(図5aや5c)は,より近接した2つのヒドロキシ基の間でアセタール化がおこる。
図4の五員環構造をとったL-ソルボースがアセトンと反応すると,分子内の5箇所のヒドロキシ基のうち,\fbox{\text{ Ⅰ }} と \fbox{\text{ Ⅱ }} に結合したものは1,2-型環構造として「保護」され,\fbox{\text{ Ⅲ }} と \fbox{\text{ Ⅳ }} に結合したものは1,3-型環構造として「保護」された。この状態で残された \mathsf{CH_2OH} 基を酸化し,その後に加水分解を行ったところ,2-ケト-L-グロン酸(図3)が合成できた。
(ⅰ) 上記の文章の \fbox{\text{ Ⅰ }} 〜 \fbox{\text{ Ⅳ }} にあてはまる炭素を,図3を参照して,\mathsf{C1} 〜 \mathsf{C6} から選べ。
隣り合う炭素に結合したヒドロキシ基がアセタール化して1,2-型環構造,間に炭素原子が1つ入った2つの炭素原子に結合したヒドロキシ基がアセタール化して1,3-型環構造ができる。いずれの場合も,より近接したヒドロキシ基どうしでアセタール化が起こる。
図Cのように, \mathsf{C2} と \mathsf{C3} に結合したヒドロキシ基は,ともに上向きで近接していて,アセタール化して1,2-型環構造をつくる。また,\mathsf{C4} と \mathsf{C6} に結合したヒドロキシ基どうしもともに下向きで近接していて,アセタール化して1,3-型環構造をつくる。
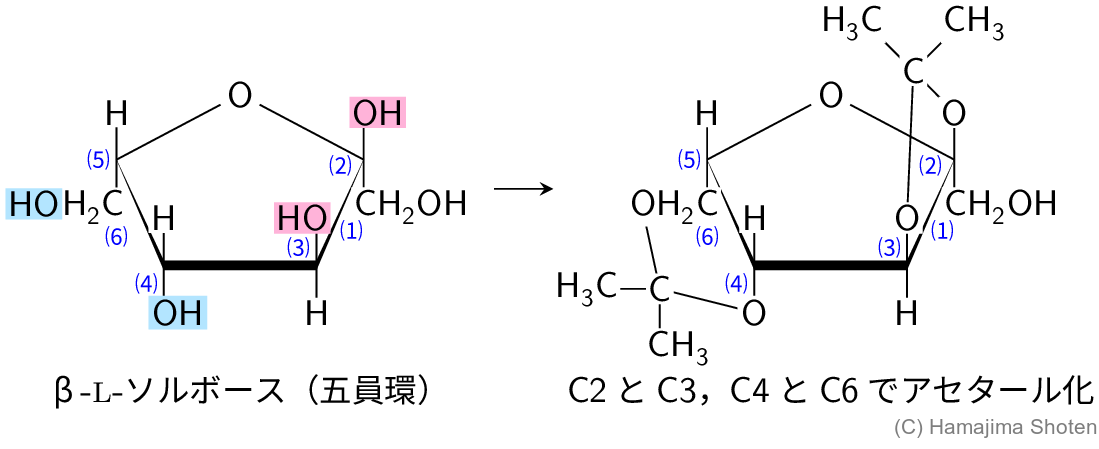
これらのヒドロキシ基が保護されるので,残された \mathsf{CH_2OH} 基のみを酸化できる。その後,アセタール化した部分を加水分解し,もとのヒドロキシ基に戻して2-ケト-L-グロン酸が得られる。
解答
Ⅰ,Ⅱ C2,C3 Ⅲ,Ⅳ C4,C6
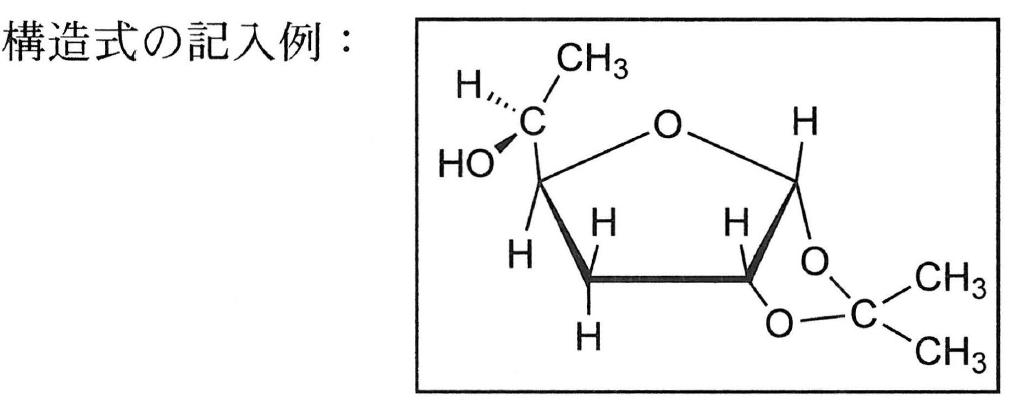
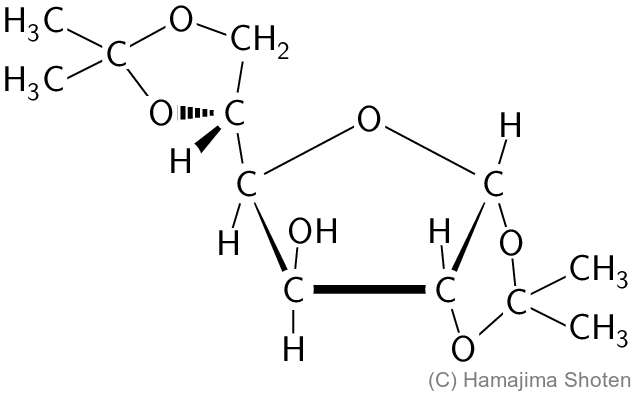
(ⅱ) 単糖類の化学反応に興味を持った大学生のAさんは,D-グルコースをアセトンと反応させ,得られた化合物の構造を解析した。その結果,D-グルコースは,水溶液中の存在比が非常に小さい五員環構造をとってアセトンと反応したことがわかった。また,その反応により得られた化合物には2つの1,2-型環構造が含まれることが判明した。Aさんが得た化合物の構造を,下記の記入例にならって示せ。不斉炭素がある場合は,その立体構造がわかるようにすること。
\mathsf{C1} のカルボニル基と \mathsf{C4} のヒドロキシ基でヘミアセタール化して環状になると,\mathsf{C1} が新たに不斉炭素原子になり,2つの異性体(α形,β形)が考えられる(図D)。
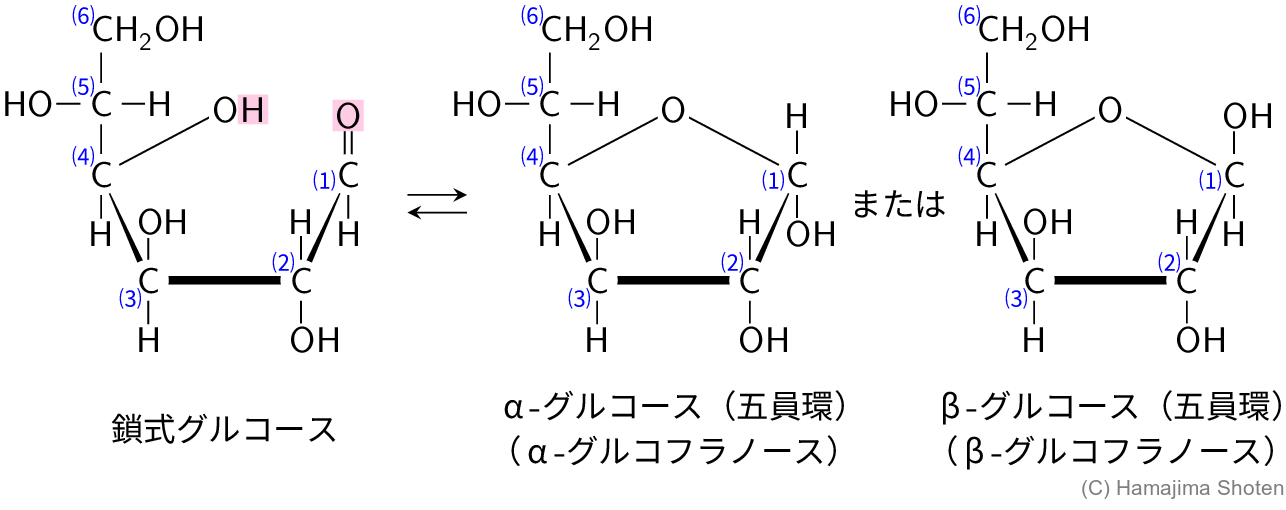
アセタール化したとき,2つの1,2-型環構造が含まれることから,反応したのはα-グルコース(五員環)だと考えられる。
α-グルコース(五員環)は,図Eのように,2か所でアセタール化する。
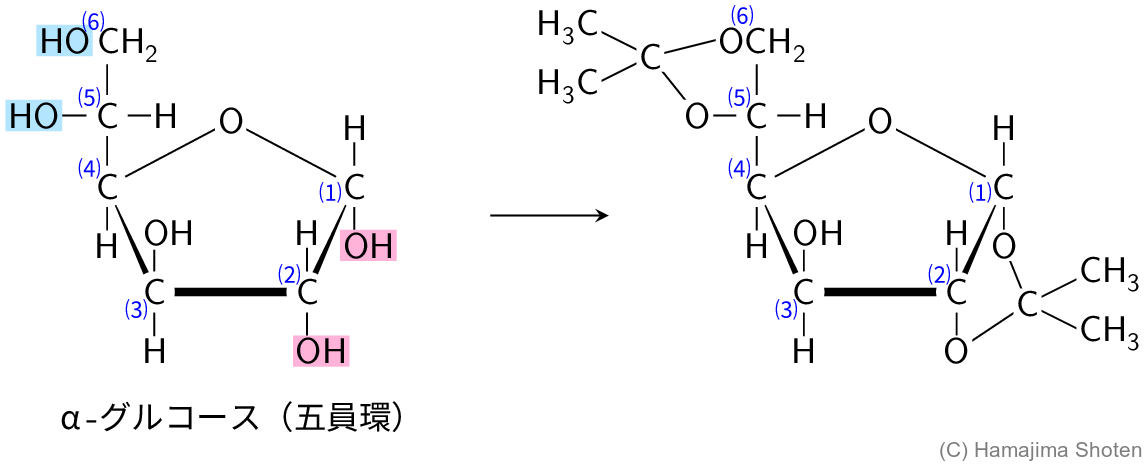
ここまで,簡易な表記で構造を表してきたが,不斉炭素原子がある場合は,その立体構造がわかるようにすることが求められているので,\mathsf{C5} の結合を記入例にならってくさび形で表し,解答とする。
解答
問3 下線部③について,L-アスコルビン酸合成の最終段階では,2-ケト-L-グロン酸から水分子がとれて縮合がおこり,環状エステルであるL-アスコルビン酸(図3)が得られた。とれた水分子に含まれている酸素原子が結合していた炭素はどれか。図3を参照して,\mathsf{C1} 〜 \mathsf{C6} から選べ。
問題の図3で,2-ケト-L-グロン酸とL-アスコルビン酸(エノール形)の比較から,\mathsf{C1} のヒドロキシ基(カルボン酸の \mathsf{OH} )と \mathsf{C4} のヒドロキシ基(アルコールの \mathsf{H} )で脱水(エステル化)すると考えられる。
したがって,とれた水分子に含まれている酸素原子は \mathsf{C1} に結合していたものである。
図Fに,2-ケト-L-グロン酸から,L-アスコルビン酸(ケト形)をへて,L-アスコルビン酸(エノール形)になる変化をまとめた。
解答
\mathbf{C1}