反応速度と温度の関係
目次
アレニウスの式
反応速度定数 k と絶対温度 T\text{〔}\mathrm{K}\text{〕} には,次の関係が成り立ち,この式をアレニウスの式という。 \begin{align} k=Ae^{-\frac{E_\mathrm{a}}{RT}} \end{align} ここで,A は比例定数(頻度因子),e は自然対数の底,E_\mathrm{a} は活性化エネルギー,R は気体定数である。
アレニウスの式 (1) の両辺の自然対数をとると, \log_e k=\log_e Ae^{-\frac{E_\mathrm{a}}{RT}} となる。この右辺は, \log_e Ae^{-\frac{E_\mathrm{a}}{RT}} = \log_e A + \log_e e^{-\frac{E_\mathrm{a}}{RT}} = \log_e A - \frac{E_\mathrm{a}}{RT} なので,整理すると, \begin{align} \log_e k=-\frac{E_\mathrm{a}}{R}\frac{1}{T}+\log_e A \end{align} となる。式 (2) は,\log_e k\rightarrow y ,-\dfrac{E_\mathrm{a}}{R}\rightarrow a,\dfrac{1}{T}\rightarrow x,\log_e A\rightarrow bと対応させると,一次関数 y=ax+b\quad (a<0) になることがわかる。
例:ヨウ化水素の分解
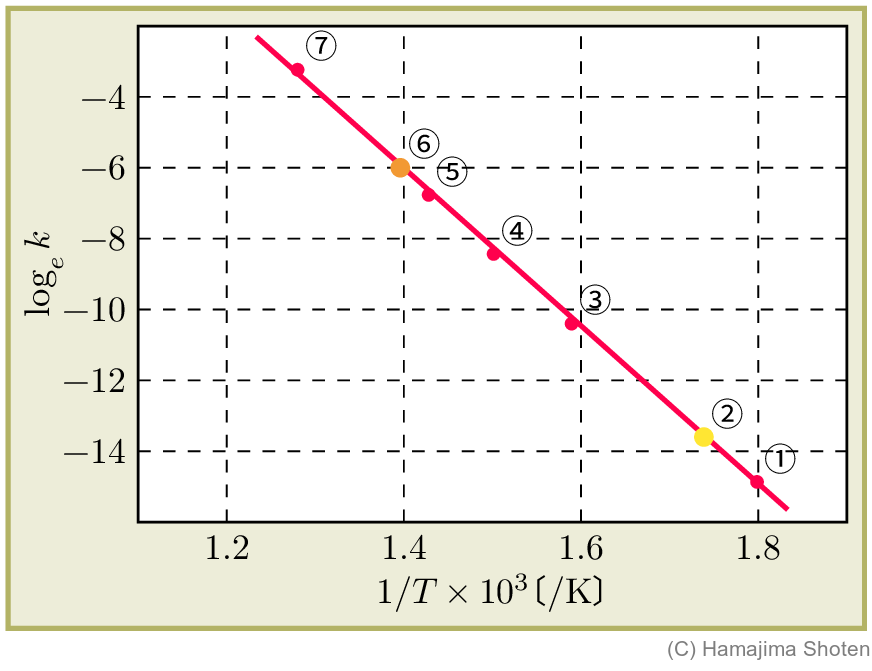
アレニウスのプロット
ヨウ化水素の分解 \mathsf{2\,HI\;\rightarrow \; H_2\;+\;I_2} について,さまざまな温度における反応速度定数を,次の表に示す。
| T\text{〔}\mathrm{K}\text{〕} | k\text{〔}\mathrm{L/(mol\cdot s)}\text{〕} | 1/T\text{〔}\mathrm{/K}\text{〕} | \log_e k | |
|---|---|---|---|---|
| ① \bullet | 556 | 3.52\times 10^{-7} | 1.80\times 10^{-3} | -14.9 |
| ② \bullet | 575 | 1.22\times 10^{-6} | 1.74\times 10^{-3} | -13.6 |
| ③ \bullet | 629 | 3.02\times 10^{-5} | 1.59\times 10^{-3} | -10.4 |
| ④ \bullet | 666 | 2.19\times 10^{-4} | 1.50\times 10^{-3} | -8.43 |
| ⑤ \bullet | 700 | 1.16\times 10^{-3} | 1.43\times 10^{-3} | -6.76 |
| ⑥ \bullet | 716 | 2.50\times 10^{-3} | 1.40\times 10^{-3} | -5.99 |
| ⑦ \bullet | 781 | 3.95\times 10^{-2} | 1.28\times 10^{-3} | -3.23 |
これをグラフに表すと,図1のようになる。
活性化エネルギーを求める
上の表で,たとえば,T=575\,\mathrm{K},T=716\,\mathrm{K} のときの値を,式 (2) に代入すると, \begin{align} -13.6 &= -\frac{E_\mathrm{a}}{R}\times 1.74\times 10^{-3}\,\mathrm{/K}+\log_e A\\ -5.99 &= -\frac{E_\mathrm{a}}{R}\times 1.40\times 10^{-3}\,\mathrm{/K}+\log_e A \end{align} となる。\text{式}(3)-\text{式}(4) から, \begin{align*} -13.6+5.99 &= (-1.74\times 10^{-3}\,\mathrm{/K}+1.40\times 10^{-3}\,\mathrm{/K})\times \frac{E_\mathrm{a}}{R}\\ E_\mathrm{a} &= \frac{(-13.6+5.99)R}{-1.74\times 10^{-3}\,\mathrm{/K}+1.40\times 10^{-3}\,\mathrm{/K}} \end{align*} が得られる。R=8.31\,\mathrm{J/(K\cdot mol)} として計算すると,活性化エネルギーを求めることができる。 E_\mathrm{a}\fallingdotseq 1.86\times 10^5\,\mathrm{J/mol}=1.86\times 10^2\,\mathrm{kJ/mol}