銅イオンの反応
次の文の下線部①,②の化学式および③,④の反応の化学反応式を書け。
硫酸銅(Ⅱ)を水に溶かすと青色の水溶液になる。この水溶液にアンモニア水を過剰に加えると,水溶液は深青色を示す。これは,①テトラアンミン銅(Ⅱ)イオンを生じるためである。さらに塩酸を少量ずつ滴下すると②青白色の沈殿が生じる。
硫酸銅(Ⅱ)をつくるには,③空気中で銅を酸化し,④表面に生じた黒色物質を希硫酸と反応させればよい。硫酸銅(Ⅱ)五水和物は青色の結晶であるが,加熱すると水和水を失い,白色粉末の無水硫酸銅(Ⅱ)になる。
「硫酸銅(Ⅱ)を水に溶かすと青色の水溶液になる。」

「この水溶液にアンモニア水を過剰に加えると,水溶液は深青色を示す。これは,①テトラアンミン銅(Ⅱ)イオンを生じるためである。」

NH3少量の場合は,Cu(OH)2の青白色沈殿が生じる。
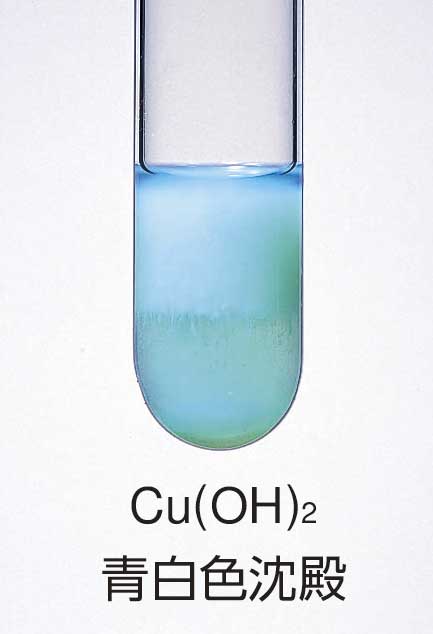
\[\mathsf{Cu^{2+} + 2OH^- → Cu(OH)_2 }\]
NH3過剰の場合は,Cu(OH)2の沈殿が溶けて錯イオンが生じる。
\[\mathsf{Cu(OH)_2 + 4NH_3 → [Cu(NH_3)_4]^{2+} + 2OH^-}\]
錯イオンの表し方
[Cu(NH3)4]2+
テトラアンミン銅(Ⅱ)イオン
① [Cu(NH3)4]2+
「配位数」+「配位子」+「金属イオン(酸化数)」+イオン の順に並べる。
配位数
| 1 | モノ | 5 | ペンタ |
|---|---|---|---|
| 2 | ジ | 6 | ヘキサ |
| 3 | トリ | 7 | ヘプタ |
| 4 | テトラ | 8 | オクタ |
配位子
| 分子 | NH3 | アンミン |
|---|---|---|
| H2O | アクア | |
| 陰イオン | OH- | ヒドロキシド |
| CN- | シアニド | |
| Cl- | クロリド |
陰イオンの場合は,最後につける「イオン」を「酸イオン」とする。
「さらに塩酸を少量ずつ滴下すると②青白色の沈殿が生じる。」

\[\mathsf{[Cu(NH_3)_4]^{2+} + 2OH^- + 4H^+ → Cu(OH)_2 + 4NH_3^+}\]
② Cu(OH)2
「硫酸銅(Ⅱ)をつくるには,③空気中で銅を酸化し,」
空気中で銅を酸化すると,黒色の酸化銅(Ⅱ)CuOが生じる。
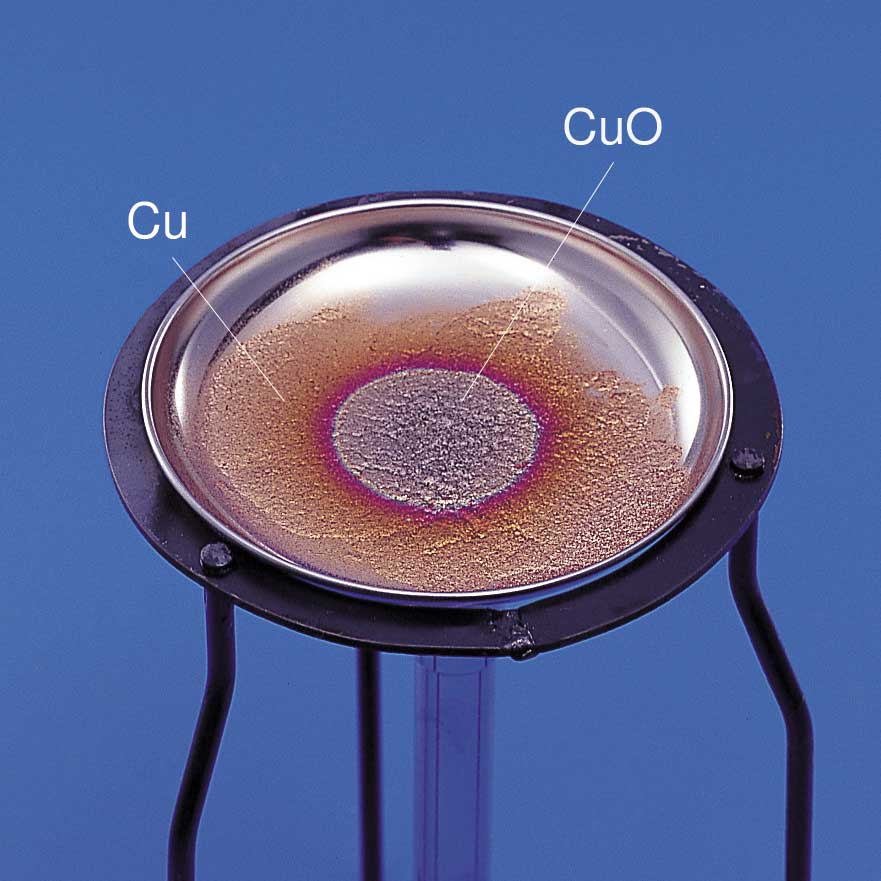
\[\mathsf{2Cu + O_2 → 2CuO}\]
「④表面に生じた黒色物質CuOを希硫酸H2SO4と反応させればよい。」
\[\mathsf{CuO + H_2SO_4 → CuSO_4 + H_2O}\]
③ 2Cu+O2→2CuO
④ CuO+H2SO4→CuSO4+H2O
「硫酸銅(Ⅱ)五水和物は青色の結晶であるが,加熱すると水和水を失い,白色粉末の無水硫酸銅(Ⅱ)になる。」

\[\mathsf{CuSO_4・5H_2O → CuSO_4 + 5H_2O}\]