気体の溶解度
0℃で1Lの水に2.0×105Paの酸素を接触させた。このとき,次の量を求めよ。 ただし,0℃,1.0×105Paで水1Lに酸素は49mL溶ける。 また,O=16とする。
(1) 溶解した酸素の質量
(2) 溶解した酸素の,その圧力下での体積
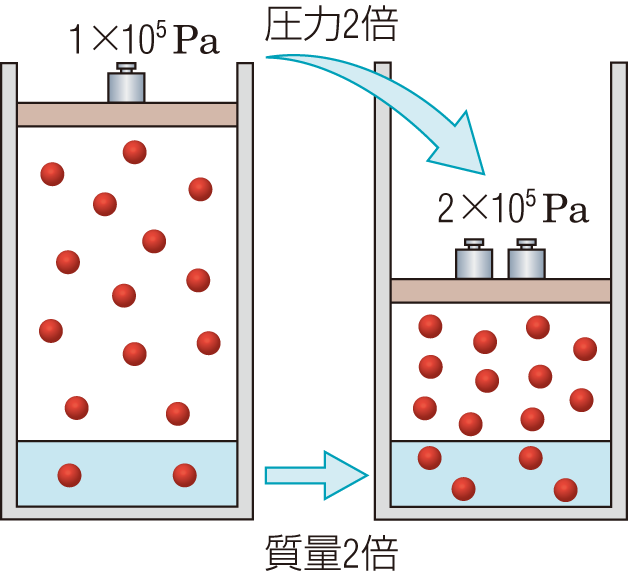
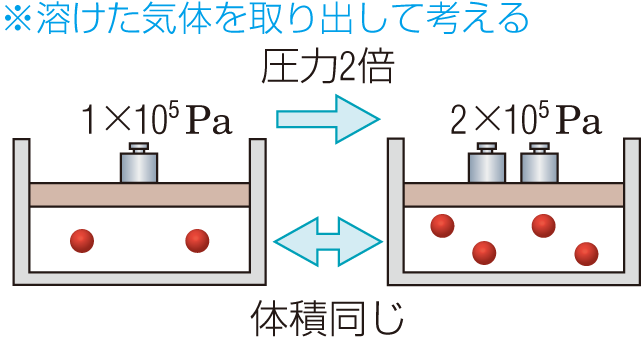
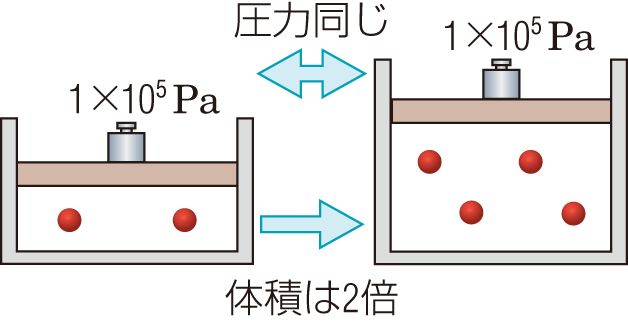
ヘンリーの法則
一定温度で,一定体積の溶媒に溶ける気体の質量(物質量)は,その圧力に比例する。
●0℃,1.0×105Paで水1Lに溶ける酸素の質量を求める。
0℃,1.0×105Paで,気体1molの体積は22.4L,
0℃,1.0×105Paで水1Lに溶ける酸素49mL(=0.049L)の物質量は,
\[ \frac{0.049 \mathrm{L}}{22.4 \mathrm{L/mol}} =\frac{0.049} {22.4} \mathrm{mol}\]
酸素O2のモル質量は32g/molだから,酸素の質量は,
\[32 \mathrm{g/mol} \times \frac{0.049}{22.4}\mathrm{mol} = 0.070\mathrm{g}\]
●0℃,2.0×105Paで水1Lに溶ける酸素の質量を求める。
ヘンリーの法則から,酸素の質量は,
\[0.070 \mathrm{g} \times \dfrac{2.0 \times 10^5 \mathrm{Pa}}{1.0 \times 10^5 \mathrm{Pa}} = 0.14 \mathrm{g}\]
圧力が2倍になると,溶ける質量(物質量)も2倍になる。
0.14g
一定温度で,一定量の液体にある気体が溶けている。圧力を3倍にすると,溶けている気体の質量は何倍になるか。
3倍
気体の状態方程式 \(PV=\frac{w}{M}RT\) より,
\[ 2.0 \times 10^5 \mathrm{Pa} \times V \\ = \frac{0.14 \mathrm{g}}{32 \mathrm{g/mol}} \times 8.31 \times 10^5 \mathrm{Pa} \cdot \mathrm{L} / (\mathrm{K} \cdot \mathrm{mol}) \times 273 \mathrm{K} \\ ≒ 5.0 \times 10^{-2} \mathrm{L} \]