イオンの電荷はどう決まる?
18族の原子と同じ電子配置のイオンになる!
ナトリウム\mathsf{Na}原子は陽イオン\mathsf{Na^+}に、塩素\mathsf{Cl}原子は陰イオン\mathsf{Cl^-}になりますが、\mathsf{Na^-}や\mathsf{Cl^+}にはならないのでしょうか。また、カルシウム\mathsf{Ca}原子は陽イオン\mathsf{Ca^{2+}}になりますが、\mathsf{Ca^+}ではなく\mathsf{Ca^{2+}}になるのはなぜでしょうか。
18族の元素(ヘリウム\mathsf{He}、ネオン\mathsf{Ne}、アルゴン\mathsf{Ar}、クリプトン\mathsf{Kr}、キセノン\mathsf{Xe}、ラドン\mathsf{Rn})は貴ガスとよばれ、ほとんど反応しない安定な元素として知られています。そして、18族以外の元素の原子には、
「原子番号が一番近い18族の元素の原子と、同じ数の電子をもつイオンになると安定する」
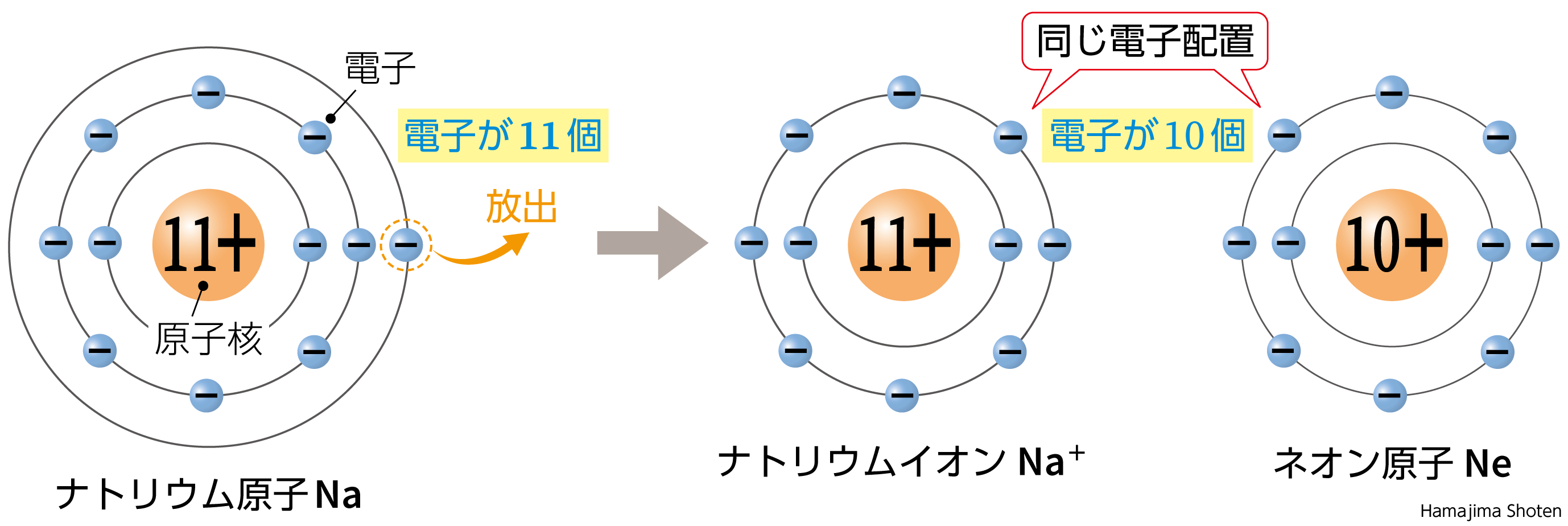
という性質(*)があります。具体例をあげると、
- \mathsf{Na}原子は電子を1個放出して、一番近い18族の\mathsf{Ne}原子と同じ数の電子をもつ\mathsf{Na^+}に
- \mathsf{Cl}原子は電子を1個受けとって、一番近い18族の\mathsf{Ar}原子と同じ数の電子をもつ\mathsf{Cl^-}に
- \mathsf{Ca}原子は電子を2個放出して、一番近い18族の\mathsf{Ar}原子と同じ数の電子をもつ\mathsf{Ca^{2+}}に
それぞれなり、安定します。イオンのもつ電荷はこうして決まります。
(*)遷移元素とよばれる元素のように、この性質をもたない元素の原子もあります。